服务范围
医疗器械注册人制度咨询返回首页
首先,医疗器械“注册人委托生产模式”是“注册人制度”的核心内容。虽然建立新的委托生产模式是释放市场要素的最直接举措,但是生产制造只是医疗器械全生命周期的其中一环,注册人制度还囊括了除此之外关于设计开发、临床试验、销售配送、售后服务、产品召回、不良事件报告等多个环节的职责划分、法律责任承担与监管内容,各环节彼此联结相互作用,其内容远远不限于委托生产。
其次,医疗器械“上市许可持有人制度”包含“注册人制度”。医疗器械实行按照风险程度分类管理。第一类医疗器械实行产品备案管理,第二类、第三类医疗器械实行产品注册管理。从主体上看,相关规定是:“取得备案凭证或者医疗器械注册证的,为医疗器械上市许可持有人。”可知,医疗器械上市许可持有人包括了第一类医疗器械的备案人与第二、三类医疗器械的注册人,“注册人”仅指第二、三类医疗器械的注册人,因此,医疗器械“上市许可持有人制度”包含“注册人制度”。
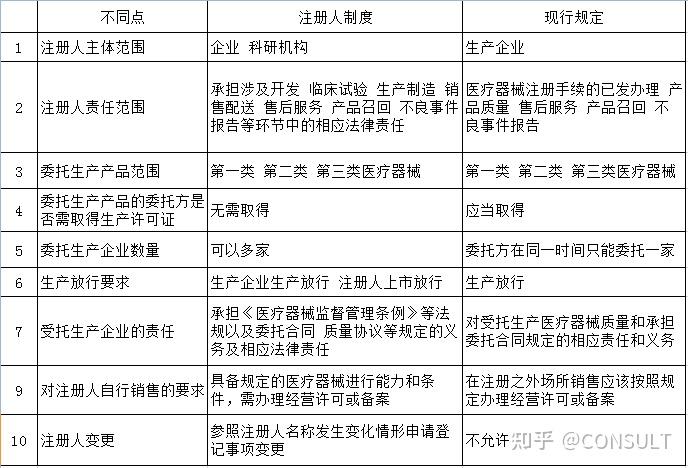
根据上述制度比照,可以看到注册人制度的两个方向:
一是尽可能释放市场要素,促进市场资源合理配置。这包括:扩展注册人主体范围、允许注册申请人申请注册时委托生产样品、注册人委托生产产品无需自行具备生产许可、可以多点委托、自行销售未要求办理经营许可、允许集团公司内部注册人变更优化整合资源等。
二是进行责任设计,细化并提升职责要求,为事中事后监管打好基础。体现在:确定注册人的全生命周期法律责任、明确受托生产企业的义务来源以及对注册人提出临床试验研究资料数据可追溯、注册人上市放行、专职法规事务人员配备等深度细化的制度要求等。
欢迎咨询医疗器械注册部张经理 13816287446
下一篇:暂时无相关信息