FDA医疗器械用户付费法案做出最新调整
医疗器械用户费用的收取源于2002年,根据《医疗器械用户收费及现代化法》的规定,生产商在进行注册、产品登记、以及提交申请或上市通告时需向FDA缴纳一定的费用。在生产商缴纳的费用的支持下,FDA承诺提高监管流程的效率以减少安全和有效的医疗器械在美国面市的时间2012年7月9日《FDA安全与创新法案》(FDASIA)正式生效,该法案涉及处方药、医疗器械、仿制药、生物仿制药生产企业的用户费用。该法案授权FDA向企业收取用户费用以支持创新型新药、医疗器械仿制药和相似生物制品(生物仿制药)的评审。该法案是对1992年开始实施的《处方药用户付费法案》(PDUFA)的第五次重新授权,同时也是对2002年实施的《医疗器械用户收费及现代化法》(MDUFA)的第三次重新授权。法案支持的项目为FDA评审专家对申请进行评审提供了稳定和可靠的支持,使他们能够在一定的时间内完成评审并且兼顾产品的安全和效用。新的FDASIA法案除了继续授权FDA收取处方药和医疗器械企业的用户评审费用外,还将对仿制药和相
似生物制品(生物仿制药)采用同样的方法,加速和提高仿制药的审批。重新获得授权的医疗器械用户付费法案(MDUFA Ⅲ)作为FDA安全与创新法案(FDASIA)的一部分,将于2012年10月1日正式生效,该法案的有效期为5年。利用收取的费用,FDA承诺在5年内雇佣超过200名训练有素的全职人员投入审核,从而提高审核的效率。
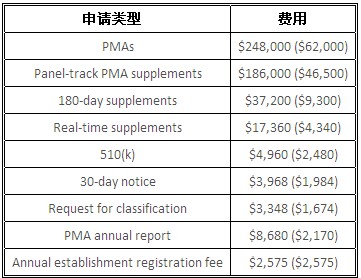
在MDUFA Ⅲ的规定下,FDA在5年内收取5.95亿美元费用,MDUFA Ⅲ也扩大了必须支付注册费用的生产商类型的定义。2013年需缴纳的医疗器械用户费用(美金)如表1(括号内为小型企业需缴纳的费用):
表1:MDUFA Ⅲ规定的企业需缴纳的费用
除此之外,根据MDUFA Ⅲ的规定,所有医疗器械机构,无论机构类型或从事的商业活动如何,从2012年10月1日开始,在进行年度注册时都必须缴纳2,575美金的注册费,小型企业将无豁免和减免)。FDA还根据不同的机构类型制定了不同的注册和产品登记要求。由于FDASIA的正式生效,注册和登记要求也做出了相应的修改。对于需要进行机构注册和产品登记的美国国外医疗器械机构,FDA做出的最新要求如下:
表2:2013年美国国外医疗器械机构最新注册和登记要求