2022年上海市第二类有源医疗器械变更注册技术审评常见问题分析
2022年上海市医疗器械化妆品审评核查中心共计受理第二类有源医疗器械变更注册157件,其中40件进行了发补,发补率25.4%。下面对技术审评发补常见问题进行分析。
一、变更注册审评发补意见分布情况
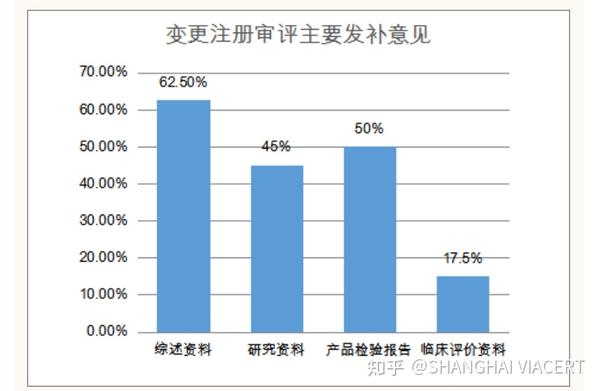
变更注册发补40件,涉及33家企业。主要集中在综述资料、研究资料、产品检验报告、临床评价资料、注册单元及产品管理类别、申请表六部分。其中综述资料发补率62.5%,研究资料发补率45%,产品检验报告50%,临床评价资料发补率17.5%。
二、变更注册审评常见问题分析
1、注册单元及产品管理类别问题
根据《医疗器械注册单元划分指导原则》,产品技术原理、结构组成、性能指标、适用范围不同时,原则上划分为不同注册单元。例如移动式摄影X射线机进行变更注册时,以新增型号高压发生器为例,需要详述变更高压发生器后,新增产品型号与原产品型号属于同一注册单元的理由,包括原材料、结构组成等。高压发生装置中的高压变压器结构不一致的(如:工频和非工频),不能划为同一注册单元,建议企业进行首次注册申报。
部分产品变更注册后产品管理类别发生变化,例如医学影像处理软件变更后可提供治疗计划制定等临床诊疗建议,变更后的产品应按照第三类医疗器械管理,建议企业在提交资料前应明确产品管理类别。
2、申请表常见问题
申请表中“变更内容”描述不清,或与提交的《变更情况说明》中的变更内容不一致。如《申请表》中描述产品结构组成有变化,但《变更情况说明》中陈述变更内容不涉及产品结构组成的变化。《申请表》应详细描述需要进行变更注册的内容,如有必要,请以《申请表》的附件形式进行详细、完整的描述。
3、综述资料常见问题
企业未根据《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》编写申报产品的综述资料,存在主要问题如下:
(1)产品变更情况说明:对变更的具体内容描述不充分,无法充分了解产品变更内容。未详细描述产品变更部分的工作原理、技术参数、结构组成和涉及的软硬件变动及临床操作使用情况;变更新增型号命名不合理,划分说明未体现型号间差异;未提供新增型号产品的主要元器件清单(包括元器件的名称、型号、技术参数、材质、供应商信息等)和新增型号产品的彩色照片,根据产品具体变更情况提供相应的说明对比表。
(2)综述资料涉及软件相关部分:未按《医疗器械软件注册审查指导原则(2022年修订版)》提交软件更新资料;未提交新增软件功能的详细设计说明,未明确新增软件功能涉及的核心算法及相关参数。
4、研究资料常见问题
(1)性能研究:未对变更的差异部分对产品安全有效性的影响进行风险分析;涉及新增部件或原材料变化,未判断变更部分对产品有效性的影响,以纤维输尿管肾镜新增型号为例,新增产品型号在结构组成中增加不锈钢管部分,增加该部分后,需提供产品的理化性能、光学性能、电气绝缘性能、防水性能、连接头拉力性能等方面的研究资料;
(2)软件研究:涉及软件变化及新增软件模块,未按照软件指导原则提供相应资料,例如视力筛选仪新增了光反射软件功能,但申报资料对此功能的相关功能原理、相关指标要求及相关依据性资料未进行详细介绍且未提供相应的依据性资料。
5、产品检验报告常见问题
未提交针对性能指标及检验方法实质性变更的检验报告,常见问题有:
(1)未提交性能指标和检验方法变化的合理理由;
(2)未提交性能指标和检验方法变化后的产品检验报告;
(3)检验报告未包括涉及变更部分全部项目的检验结果。
6、临床评价资料常见问题
企业申请变更适用范围,但未提交相应的临床评价资料,如人工耳蜗声音处理器更改产品适用范围,在原适用范围中增加了适配的人工耳蜗植入体型号,但未提交相应的临床评价资料。
备注:以上分析按照《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》的申报资料先后顺序排序。
三、 对本市二类有源医疗器械变更注册的建议
本文对2022年上海市第二类有源医疗器械变更注册常见发补问题进行了梳理与分析,其中最常见的三个主要问题集中在:综述资料、产品检验报告、研究资料。
综述资料部分,企业应当详细描述本次变更情况、变更的具体原因及目的,让审评人员对变更产品能有整体的把握和了解,使产品的风险能更清晰地被识别。在产品变更情况描述部分,根据产品具体变更情况提供相应的说明及对比表,包括产品技术要求变更对比表,结构组成对比表,适用范围对比表等。
关于研究资料,建议企业根据《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》进行编写,根据变更产品的技术特征,提供研究综述,逐项描述所开展的研究,提供相应的研究资料。研究资料应当包括产品性能指标的确定依据、设计输入来源等内容。研究资料应当足够充分,能够证明产品的安全性和有效性。对于包含软件组件的产品,也应当根据《医疗器械软件注册审查指导原则(2022年修订版)》的要求提交产品软件研究资料。
在产品检验报告部分,应关注产品技术要求变化部分,应提供变化后的检验报告,检验报告应包括变更部分的全项检测,送检样品应能覆盖所有型号规格。
医疗器械注册申报欢迎咨询 张经理13761666890












