2021-2022年上海市第二类独立软件首次注册技术审评常见问题分析
一、首次注册审评发补意见分布情况
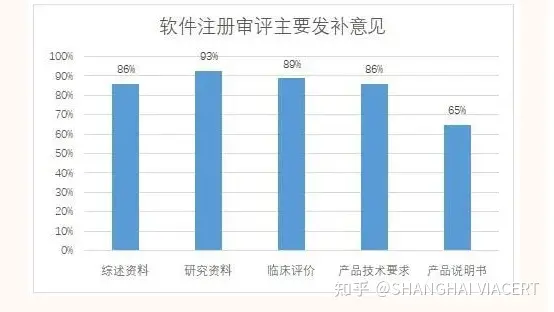
2021-2022年共对29件首次注册进行了发补,涉及23家企业,发补意见主要集中在综述资料、研究资料、临床评价、产品技术要求、产品说明书五个部分(见图一),其中综述资料发补率86%,研究资料发补率93%,临床评价发补率89%,产品技术要求发补率86%,产品说明书发补率65%。
二、首次注册审评常见问题分析
1、注册单元及产品管理类别问题
根据《医疗器械软件注册审查指导原则》《医疗器械软件注册审查指导原则》,独立软件注册单元以管理类别、预期用途、功能模块作为划分原则。不同管理类别的独立软件作为不同注册单元,若在技术上无法拆分可作为一个注册单元并按照较高管理类别申报注册。不同预期用途的独立软件作为不同注册单元,对于功能庞大复杂的独立软件,依据功能模块的类型和数量划分注册单元,每个注册单元所含功能模块数量需适中。按照功能模块类型可分为平台功能软件和特定功能软件。
部分软件管理类别不明确,有些软件属于三类医疗器械或不属于医疗器械,需进行分类界定,例如:人工智能辅助诊断类软件、医院管理类软件,建议企业在提交资料前进行分类界定明确产品管理类别。
2、综述资料常见问题
企业应当根据《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》和《医疗器械软件注册审查指导原则》,编写申报产品的综述资料,存在主要问题如下:
(1)产品作用机理:未详细描述软件的具体功能,未描述功能的核心算法与具体实现方式。
(2)结构组成:未明确软件的架构和规模,产品的交付内容和具体功能,如医学影像处理软件未明确交付内容,同时也未明确软件对应的具体软件功能。
(3)适用范围:未明确软件具体的处理、评估功能,应明确软件的具体功能;产品适用范围超出《医疗器械分类目录》中对于相应分类的描述,例如血液透析信息管理软件,需要判定是否按医疗器械管理,并依据软件的实际功能规范产品名称及适用范围的表述。
(4)其他相关:软件功能表述不清晰,相关功能的临床用途和意义不明确;未按照软件指导原则规范制定软件发布版本与版本软件命名规则;未明确软件算法、数学模型的原理和临床依据,包括计算分析处理过程等内容;软件描述文档不完善;未详细描述软件所有的交付内容和形式;未对软件安装和部署方式进行介绍;未详细描述软件架构(如BS、CS)的实现方式;未对软件中使用的现成软件进行介绍。
3、研究资料常见问题
(1)性能研究:提供的软件性能指标、产品技术要求的编制说明的确定依据不清晰不明确;例如血液透析信息管理软件,未说明软件监控警告功能及设计考虑。
(2)软件研究:未按照《医疗器械软件注册审查指导原则》《医疗器械网络安全注册审查指导原则》要求提交产品软件研究资料和网络安全资料,存在主要问题如下:①未对软件安全级别进行详细描述,安全级别判定理由不合理,未根据软件安全性级别提交相应资料;②软件核心功能、核心算法描述过于简单,缺少测量准确性研究和验证资料;③软件描述文档中软件版本信息与检验报告不一致。④错误认定产品不涉及网络安全。
例如:医学影像处理软件的安全性级别综合应考虑软件管理类别、预期用途、使用场景等因素;如适用,需提交《医疗器械软件注册审查指导原则(2022年修订版)》中所要求的外部软件环境评估报告;产品的软件版本命名规则,需考虑网络安全更新情况,软件命名规则应给出具体举例,并明确是否须进行注册变更;
单机软件也应根据《医疗器械网络安全注册审查指导原则(2022年修订版)》评估产品相应风险和适用项,并提交产品网络安全资料。
4、临床评价资料常见问题
(1)免临床评价目录(以下简称目录)内产品:与境内已注册产品的对比不全面,未考虑主要性能指标、软件功能等方面差异;对软件功能、实现方式等软件功能差异分析不充分,不能证明两者具有基本等同性;缺少对比产品注册批件或说明书等支持性资料。
(2)通过同品种器械开展评价:如提交的同品种产品临床数据欠缺可比性和充分性,未充分考虑适用范围、处理对象、应用场景的差异,两者适用范围不同的差异,不能证明两者具有广泛相似性;提交的临床文献中缺少同品种产品信息,未说明两者相关性;临床文献无实质内容,也未开展对比测试或验证;未对文献数据进行分析,也未评估其对申报产品性能与安全性论证的贡献。
5、产品技术要求常见问题
产品技术要求遵循的原则有《医疗器械产品技术要求编写指导原则》。产品技术要求存在问题:
(1)缺少部分性能指标、指标不合理;(2)缺少软件功能,软件功能描述不清晰;(3)软件版本、命名规则不完整、缺少典型运行环境;(4)附录中缺少必要的内容,如缺少非标体模、测试软件等信息;(5)检验方法不合理,不明确;(6)结构组成不完整、型号规格划分不清晰。6、产品说明书常见问题医疗器械产品说明书可参考以下具体文件《医疗器械说明书和标签管理规定》《医疗器械软件注册审查指导原则》对说明书的要求。常见问题如下:(1)说明书中描述内容与综述资料、研究资料不一致;(2)说明书中性能指标与产品技术要求不一致;(3)未涵盖《医疗器械说明书和标签管理规定》中要求的内容或描述不清晰;(4)说明书内容未在技术要求中体现。文章来源自上海器审 医疗器械注册申报欢迎咨询 张经理13761666890